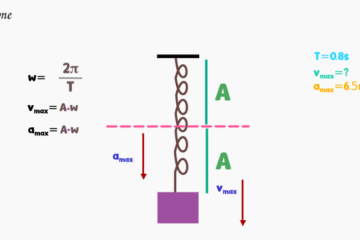
Problema:
Se deja una cuchara de aluminio de 100 gramos de masa que está a 20ºC dentro de una sartén de aceite que contiene 0,5 litros a 80ºC. Si en una situación ideal suponemos que no se disipa energía en el ambiente, ¿cuál será la temperatura cuando se alcance el equilibrio térmico?. Coeficiente de calor especifico del aluminio = 896 J/kg ºC y del aceite 2508 J/kg ºC. Densidad del aceite: 900 kg/m3.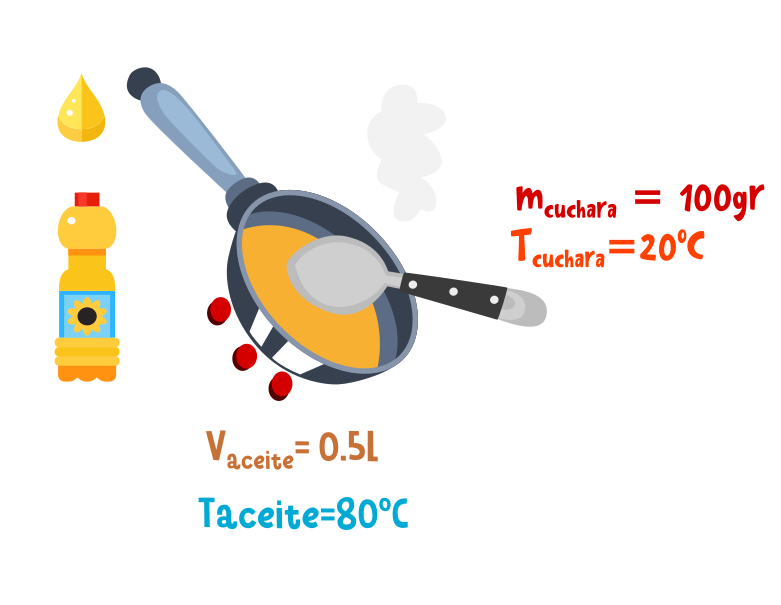
Datos:
Donde:
= Masa del aluminio.
= Volumen del aceite.
Temperatura final.
= Temperatura inicial del aluminio.
= Temperatura inicial del aceite.
= Cantidad de calor.
= Incremento de la temperatura.
= Calor especifico.
= Densidad.
= Volumen.
Formulas:
(1)
(2)
(3)
(4)
Solución:
La temperatura final, es la temperatura que obtiene el aceite y la cuchara cuando alcanzan el equilibrio térmico. Partiendo de esto lo primero que podemos hallar para resolver el problema es la masa del aceite.
Primero:
La masa del aceite lo encontramos convirtiendo los 0.5 litros a metros cúbicos y luego reemplazando este valor junto con la densidad del aceite en la formula (4).
Segundo:
Como la masa del aluminio esta en gramos lo convertimos a kilos.
Obtenemos la cantidad de calor del aluminio con la formula (1).
Tercero:
Ahora obtenemos la cantidad de calor del aceite con la formula (1).
Cuarto:
Con las 2 cantidades de calor hacemos una ecuación igualada a cero para despejar la temperatura final.
Redondeando a dos decimales:
Conclusión: 75.59ºC es la temperatura cuando alcanzan el equilibrio térmico.
Si encuentras algún error por favor dejalo en los comentarios, para que pueda rectificar el ejercicio.